No agli “YouTube trials”

In Italia le lezioni non si apprendono mai. Le sperimentazioni cliniche imposte a furor di popolo hanno raggiunto nuove vette di follia: un video su youtube, condiviso da un imprenditore romano in vacanza, ha messo in moto un meccanismo che ha visto il governatore del Veneto Zaia fare pressione e quindi AIFA approvare una sperimentazione con un farmaco antivirale normalmente usato per l’influenza.
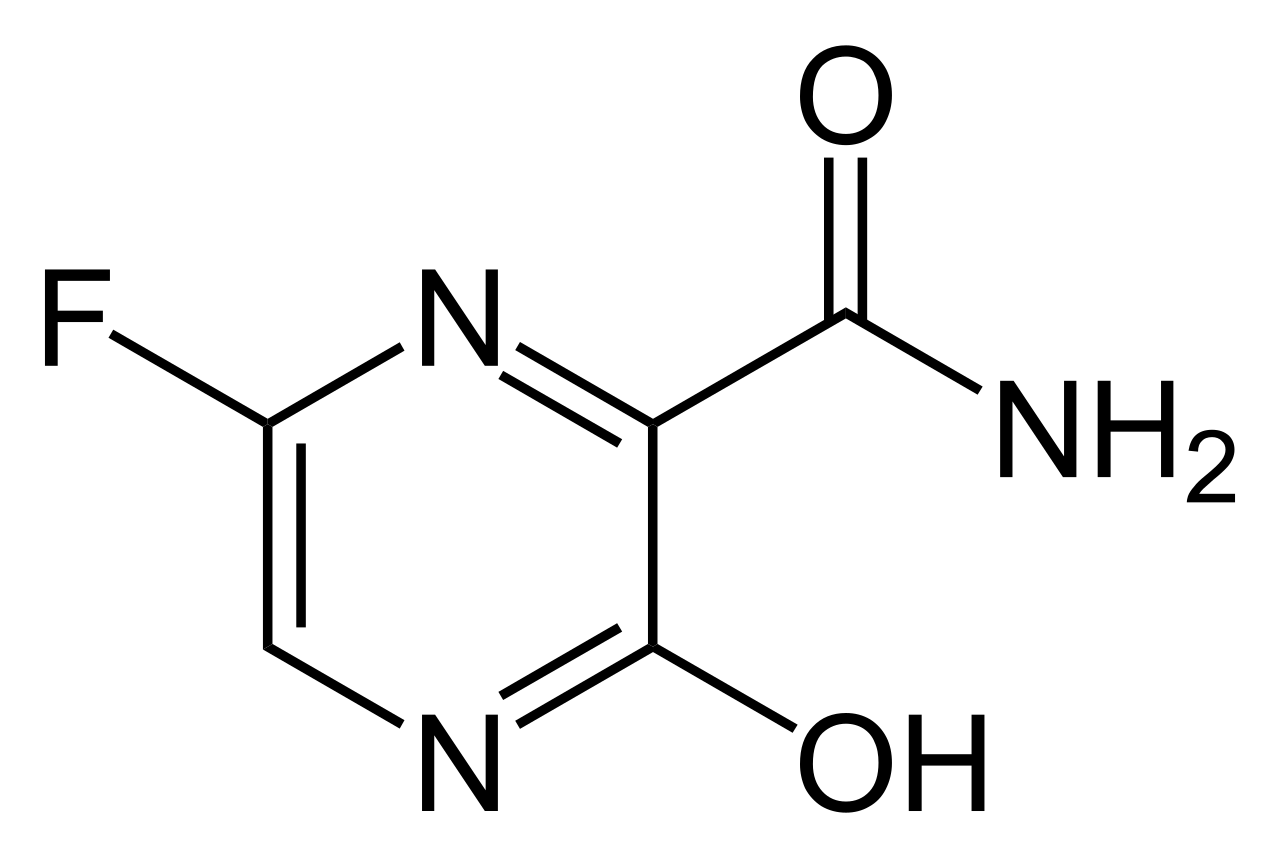
Il farmaco contiene come principio attivo un inibitore di polimerasi virale, Favipiravir, la cui formula è riportata qui sotto.
Fin qui, questo è quello che sappiamo circa la sua efficacia in pazienti affetti da COVID-19:
- c’è un recentissimo articolo scientifico su una rivista di ingegneria (!) che descrive il suo utilizzo in 35 pazienti paragonati a 45 pazienti trattati con ritonavir (che oggi sappiamo essere inefficace)
- c’è un pre-print (non sottoposto ancora a peer review) su una prova in cui il farmaco è paragonato ad un altro trattamento sperimentale (arbidol), con risultati di dubbia efficacia
- ci sono una molteplicità di dichiarazioni giornalistiche dei medici e delle agenzie cinesi, che hanno affermato una “chiara efficacia” del farmaco sui pazienti trattati
- ci sono le dichiarazioni delle autorità coreane del 16 marzo, che, in vista della mancanza di prove di efficacia e di possibili effetti collaterali, hanno scartato l’impiego del farmaco in Sud Corea
- c’è la riserva del Giappone, che non comunicherà nessuna notizia circa l’efficacia dell’antivirale prima del termine, fra alcuni mesi, di un trial in corso su 86 pazienti
Cominciamo con il dire una cosa chiara: nessuno dei due studi che dimostrerebbero una presunta efficacia in COVID-19 del farmaco ha valenza poco più che aneddotica.
In entrambi i casi, si tratta di studi che non sono condotti in cieco, mal controllati (perchè il confronto è fatto con altri trattamenti sperimentali, e dunque non si sa se ciò che si vede sia un mirglioramento rispetto a qualcosa di efficace o un peggioramento di chi è trattato nel braccio di controllo con qualcosa di dannoso), con i pazienti mal arruolati (perchè, in condizioni di emergenza, non si può certo fare molto di diverso da arruolare retopsettivamente pazienti comunque trattati, con tempi di trattamento diversi, senza controllo per le classi di età) e, soprattutto, di potenza statistica insufficiente (i pazienti cioè sono troppo pochi per rivelare effetti reali e non fluttuazioni casuali).
Si badi bene: la maggior parte di questi difetti e limitazioni sono discusse dagli stessi autori.
Da questo punto di vista, non esiste nessuna prova di efficacia clinica, ma solo un suggestivo quadro di benefici derivati dall’uso del farmaco in condizioni caotiche, che potrebbe benissimo essere dovuto al caso e al bias degli sperimentatori (che anche se non sono youtubers sperano vivamente di aver trovato un rimedio, quando vedono i pazienti guarire).
Resta poi il punto che in Giappone, ove si sta conducendo un piccolo trial in condizioni controllate, ed in Corea, ove si è reputato di non avere dati per procedere, si è stati estremamente cauti e non ci si è affatto lanciati nelle trionfalistiche affermazioni che vediamo circolare anche nel nostro paese. Si tenga conto che Giappone e Corea, guarda caso, sono i paesi che hanno contenuto al meglio l’infezione e hanno riportato la più bassa letalità del virus; questi sarebbero quindi i modelli a cui probabilmente bisognerebbe ispirarsi, non la Cina di Wuhan, che in condizioni disperate ha cercato di fare tutto il possibile, ma certo non ha potuto preoccuparsi (per il momento) di fornire dati scientifici affidabili circa l’efficacia di una cura.
E in Italia?
In Italia, AIFA ha affermato che “mancano dati sulla reale efficacia nell’uso clinico e sulla evoluzione della malattia” e che “ci potrebbero essere inevitabili distorsioni di selezione nel reclutamento dei pazienti”; tuttavia, non ha retto alle pressioni dell’opinione pubblica, del ministero e della regione veneto, dando nonostante tutto il via libera alla sperimentazione.
Ora la domanda che ci si pone è questa: è mai possibile passare in meno di una settimana da un video su YouTube ad una sperimentazione autorizzata da un’agenzia nazionale che dovrebbe valutare approfonditamente quali farmaci immettere nelle varie sperimentazioni contro un virus pericoloso?
Da quando in qua le sperimentazioni iniziano perchè “il popolo lo vuole”?
Vogliamo forse ripetere l’esperienza di Stamina, del protocollo Di Bella o del siero di Bonifacio?
A parte queste domande di ordine generale, consideriamo alcuni aspetti specifici.
Favipiravir/Avigan è un farmaco che inibisce la RNA polimerasi virale, inducendo rapida mutagenesi nei virus esposti (e quindi, con questo meccanismo, riducendone la letalità). In realtà, proprio questo tipo di meccanismo di azione (denominato “mutagenesi letale”, ove si intende che sia letale per il virus), causa anche resistenza, portando all’emersione ceppi virali mutati in grado di tollerare il composto.
Nel caso dell’influenza, la combinazione con altri antivirali ha dimostrato la pericolosa proprietà di portare all’emersione di ceppi resistenti e più aggressivi, proprio a causa dell’accelerato tasso di mutazione virale. In particolare, la perdita di fitness (chiamiamola vitalità) del virus dell’influenza, dovuta alle mutazioni per resistere al farmaco, può essere compensata da altre mutazioni della polimerasi virale, come spiegato sulla importante rivista scientifica PNAS.
Già da sola la considerazione del meccanismo d’azione di Favipiravir, basato sull’induzione di forte mutagenicità nel virus, dovrebbe quindi spingere ad un’estrema prudenza nel suo utilizzo su larga scala; ma, soprattutto, lo stesso lavoro che ha stabilito in vitro l’efficacia del Remdesivir contro il coronavirus SARS-CoV-2 ha pure mostrato che Avigan/Favipiravir è efficace solo a concentrazioni molto alte (EC50 = 61.88 μM, CC50 > 400 μM, SI > 6.46).
Vi è poi un aspetto non trascurabile che riguarda la sicurezza dell’impiego di Avigan sulle donne: in animale, questo farmaco ha mostrato di indurre seri difetti sui neonati, ragion per cui il trial giapponese non prevede arruolamento di donne incinte.
Per tutti questi motivi, è da tempo noto che, per un antivirale ad ampio spettro come Favipiravir, potenza, efficacia e sicurezza (anche in termini di induzione di resistenza) sono aspetti da valutare molto approfonditamente, prima di lanciare trial clinici; anche recentemente, per esempio, questi aspetti erano sottolineati sulla rivista di settore Antiviral Research.
Vi sarebbe ancora molto, moltissimo da dire circa la reale efficacia e la reale sicurezza di questa molecola. Più importante, però, mi sembra a questo punto chiedere: possiamo rischiare di far partire un trial dopo una valutazione di pochissimi giorni, solo perchè youtubers e il governatore di una regione lo chiedono, per mostrare di far qualcosa durante un’emergenza sanitaria?
Possiamo lasciar cadere le barriere che distinguono la scienza e la sicurezza clinica dalle prove casuali e dai rimedi pericolosi, sulla base di tenuissime prove di efficacia, invece di aspettare i risultati di un serio trial in corso in una nazione avanzata come il Giappone, mettendo a rischio i malati già provati da COVID-19?


Come fare a far si che si prendano decisioni più razionali?
Mi sfugge il motivo per cui i trial clinici condotti in Giappone non debbano essere biasimati per aver lasciato cadere “barriere che distinguono la scienza e la sicurezza clinica dalle prove casuali e dai rimedi pericolosi” e mi chiedo per quali potenziali antivirali non si possa lamentare la tenuità delle prove di efficacia.
Nei tre mesi in cui si attendono conferme che il Favipiravir sia inefficace si farà un uso compassionevole di altri antivirali? Quali?
Non tutti i trial clinici si concludono con la conferma di efficacia del prodotto sottoposta a valutazione ma, a rigor di logica, tali sperimentazioni vengono approntate proprio al fine di raggiungere un livello di evidenze tale da poterne valutare l’utilità ( o l’inutilità, nonostante le aspettative).
Chiaramente l’emergenza SARS-Cov2 complica anche le sperimentazioni ( anche da un punto di vista etico) ma sembra che i giapponesi abbiano preferito non attendere gli italiani che attendono:
Nell’eventualità che Favipiravir si dimostri eventualmente inefficace si spera abbiano debitamente informato dei rischi i pazienti reclutati nella sperimentazione (a maggior ragione se abbiano rinunciato a ben più promettenti opzioni)
PS: Anche gli antibiotici hanno dimostrato la pericolosa proprietà di portare all’emersione di ceppi resistenti e più aggressivi. La multiresistenza preoccupa per la prospettiva che le persone debbano fronteggiare le infezioni senza antibiotici efficaci, neanche in associazione.
In prodotto che fonda il suo meccanismo sulla mutagenesi letale comporta rischi non solo per i pazienti. Inoltre, i trial da condurre si scelgono sulla base delle probabilità di successo, non si conducono prove a caso, specie se i dati in vitro evidenziano bassa efficacia; e per un Giappone che ha autorizzato un trial di un’azienda giapponese, c’è una Corea che invece si è rifiutato di farlo.
Quanto ai coreani sembra che una tardiva pubblicazione in pre-print non abbia riscontrato efficacia del Favipiravir in vitro. (DOI: 10.1101/2020.03.20.999730 )
Il non autorizzare un trial perché “non ci sono sufficienti dati clinici” (cioè trial) che confermino l’efficacia costituirebbe un diallele ed è pertanto interpretazione da scartare in favore della concezione che ammette l’uso generalizzato (al di fuori dei trial) di qualsivoglia farmaco solo in presenza di sufficienti evidenze cliniche.
PS: Avrei detto dovesse preoccupare più la scarsità di multiple opzioni terapeutiche che l’eventualità che queste possano non risultare perpetuamente efficaci.
Con o senza favipiravir mutazioni nel SARS-CoV-2 sono inevitabili e dunque i rischi paventati ineliminabili. (DOI: 10.1128/mBio.00221-18 )
Oppure si può essere già certi che _tutte_ le eventuali mutazioni idonee a generare resistenza ad antivirali eventualmente impiegati su vasta scala ne ridurrebbero parimenti la fitness?
RIpeto anche a lei: questo antivirale ha un meccanismo particolare di azione, detto di “mutagenesi letale”. GUardi cosa significa e capirà perchè è più rischioso di altri.
Riguardo le evidenze di efficacia,hanno giusto ritirato un articolo oggi, per motivi non chiari: perchè dobbiamo inseguire un mutageno virale, con scarsi elementi di efficacia dimostrata e con effetti collaterali pesanti?
“ne ridurrebbero parimenti la fitness” cioè mutazioni che riducano la fitness dei ceppi mutati.
Come funzionerà Solidarity, il mega-trial clinico per farmaci contro il nuovo coronavirus
(Remdesivir; Clorochina/Idrossiclorochina; Ritonavir + lopinavir; Ritonavir + lopinavir + interferon beta)
“Una sperimentazione da record in ogni senso, dunque. Per tale motivo – avvertono dall’Oms –
non si escludono dei cambiamenti in corso d’opera.”
https://www.wired.it/scienza/medicina/2020/03/24/coronavirus-solidarity-trial-oms-covid-19/
Gilead pauses access to experimental Covid-19 drug due to ‘overwhelming demand’
https://www.statnews.com/2020/03/22/gilead-suspends-access-to-experimental-covid-19-drug-remdesivir/
Io aggiungerei anche le dichiarazioni di Mario Lavizzari, Corporate Senior Director di Fujifilm Italia:
“Al momento non esistono prove scientifiche cliniche che dimostrino l’efficacia e la sicurezza di Avigan contro Covid-19 nei pazienti”; “Fujifilm è al corrente della grave situazione che si sta verificando in Italia, tuttavia in questa fase Fujifilm non è in grado di divulgare alcun piano per l’uso di Avigan in altri paesi”; “Avigan è ora somministrato a pazienti di Covid-19 in Giappone ai fini di uno studio di osservazione condotto da istituzioni mediche che cooperano con i team istituiti dal Centro Nazionale per la Salute e la Medicina Globali del Giappone (National Center for Global Health and Medicine of Japan).”; “Sappiamo anche che Favipiravir (versione generica) è stato somministrato a pazienti Covid-19 in Cina. Fujifilm non ha svolto alcun ruolo nelle ricerche di cui sopra e non è quindi in grado di commentare questi risultati”.
E se lo dicono pure loro…
Grande Enrico
Favipiravir versus Arbidol for COVID-19: A Randomized Clinical Trial
https://doi.org/10.1101/2020.03.17.20037432
Citato nel post.
è questo l’articolo di antiviral research menzionato nel post?
Favipiravir as a potential countermeasure against neglected and emerging RNA viruses
https://doi.org/10.1016/j.antiviral.2018.03.003
La determina 17 marzo 2020 dell’AIFA ha autorizzato l’uso di clorochina, idrossiclorochina, lopinavir/ritonavir, darunavir/cobicistat, darunavir/ritonavir per il trattamento anche in
regime domiciliare dei pazienti affetti da infezione da SARS-CoV2. L’impiego di tali farmaci e’ riferito al trattamento e non alla profilassi per il COVID-19. https://www.aifa.gov.it/web/guest/-/azioni-intraprese-per-favorire-la-ricerca-e-l-accesso-ai-nuovi-farmaci-per-il-trattamento-del-covid-19
Salve,
questo suo articolo è molto citato dai “debunker” dell’Avigan perchè rilanciato su un sito più noto in Italia (MedicalFacts) sito gestito da un noto virologo a cui non è andato giù che l’AIfa si sia spinta alla sua sperimentazione.
Però un conto è criticare il video e ciò che magari dice e non dice, un altro è dire che il farmaco non si doveva sperimentare.
Tra l’altro il video solleva dubbi sulla condotta dell’Aifa, a cui nessuno ha dato degna risposta.
Tornando all’Avigan, vorrei chiederle: lei ha scritto: “Favipiravir/Avigan è un farmaco che inibisce la RNA polimerasi virale, inducendo rapida mutagenesi”. Cioè secondo lei, non favipiravir, ma la stessa inibizione di RdRp porterebbe alla veloce propagazione di ceppi virali mutati.
Però anche l’altro antivirale oggi in sperimentazione, il Remdesivir, è un inibitore di RdRp (https://it.wikipedia.org/wiki/Remdesivir#Meccanismo_d'azione_e_resistenza).
Analogamente, sulla questione della teratogenesi, il rischio sembra esistere anche (per esempio) per il Ritonavir (https://it.wikipedia.org/wiki/Ritonavir#Gravidanza_e_allattamento), che si sa essere usato in combinazione con altro antivirale per l’HIV e per i Covid19.
Mi piacerebbe sapere perchè alcuni antivirali anche in fase di sperimentazione, con gli stessi meccanismi d’azione e potenziali effetti collaterali possono essere accettabili e altri no…
Si sbaglia. Cerchi il meccanismo specifico di Avigan. Troverà “mutagenesi letale”. Studi cosa significa e ne riparliamo. Le consiglio pure di ritrovare i saggi di induzione di mutazione su altri rna virus da parte di avigan. Poi guardi a che dose si ha Ic50 in vitro.
Se è plausibile che la commissione di esperti giapponesi che ha autorizzato il Favipiravir non abbia visto il “video su Youtube”, è forse plausibile che anche loro non fossero al corrente della “mutagenesi letale”? Se non erro in Giappone il Favipiravir è prescrivibile per l’influenza ma non come farmaco di prima scelta.
La tesi è stata presentata in modo incongruente a partire dal suggerimento di attendere i risultati del trial in Giappone dunque implicitamente introducendo la possibilità che le argomentazioni proposte non potessero essere conclusive.
Non si trattava di “inseguire” alcunché ma di ridurre il rischio di “bias di conferma” soffermandosi a considerare la necessità di ulteriori informazioni nel tentativo di risolvere gli aspetti controversi in un senso o nell’altro (oppure ad astenere il giudizio in attesa di nuovi elementi).
L’opinione che la _priorità_ nel sottoporre a trial un potenziale candidato quale il Favipiravir possa essere stata _minore_ “rispetto ad altri” appare certamente ragionevole e ben circostanziata ma trattandosi deliberazioni di enti pubblici che riuniscono commissioni di esperti, sarebbe stato certamente istruttivo leggere nel dettaglio le argomentazioni che li hanno portati ad autorizzare la sperimentazione del Favipiravir per metterle a confronto con quelle qui presentate.
Che non esistessero prove di efficacia di sufficiente significatività statistica sul Favipiravir era pacifico ma alcune argomentazioni proposte, messe in contesto con alcuni dati di fatto comunemente noti, individuano criticità per le quali non è risultata reperibile informazione chiarificatrice.
Chiunque può confermare l’impiego attuale di farmaci dai pesanti effetti collaterali (per es. embriopatia da warfarin) o dalle posologie in migliaia di milligrammi (giacché taluni antibiotici sono inefficaci contro certi patogeni se somministrati a basse dosi) e veniamo continuamente edotti sulla problematica della multi-resistenza antibiotica o sul rischio costitutivo di mutagenesi di svariati patogeni (inclusa l’incognita che veda alcuni esperti suggerire che il SARS-CoV-2 possa diventare “più buono”): Tali analogie risultano potenzialmente pertinenti e sollecitano cautela verso enunciazioni apodittiche.
Se non erro antivirali o antibiotici vengono talvolta somministrati in combinazioni sinergiche per aumentarne l’efficacia o per ridurre i rischi di resistenza. Il rischio di resistenza non sembra abbia indotto alcuno a rinunciare all’uso di antibiotici (piuttosto che a razionalizzarne l’uso). Chiaramente un principio attivo già efficace a basse dosi potrebbe consentire maggiori margini di aumento del dosaggio qualora gli specialisti ne valutino la necessità. Gli effetti collaterali in sé non sono condizioni sufficienti a scoraggiare l’uso, bensì subordinano l’uso a valutazioni di benefici contro rischi e dunque rendono preferibili le eventuali alternative efficaci con minori effetti collaterali (accertati in vitro cc50, su modelli animali, durante i trial o con farmacovigilanza)
PS: Quanto alla “mutagenesi letale” sembra che l’IAV non abbia proofreading a differenza di SARS-CoV&SARS-CoV-2 dotati di nsp14-esoribonucleasi. (DOI 10.1371/journal.ppat.1003565 ).